
تجهیزات و دستگاه های پزشکی
دستگاه پزشکی هر وسیله ای است که برای اهداف پزشکی مورد استفاده قرار می گیرد. تجهیزات پزشکی با کمک به ارائه دهندگان خدمات درمانی در تشخیص و درمان بیماران و کمک به بیماران برای غلبه بر بیماری یا بیماری و بهبود کیفیت زندگی به بیماران کمک می کند. هنگام استفاده از یک دستگاه برای مقاصد پزشکی ، پتانسیل قابل توجهی برای خطرات ذاتی است و بنابراین قبل از اینکه دولتها اجازه بازاریابی دستگاه در کشور خود را بدهند ، دستگاه های پزشکی باید با اطمینان معقول ایمن و موثر باشند. به عنوان یک قاعده کلی ، با افزایش خطر دستگاه ، میزان آزمایش مورد نیاز برای ایجاد ایمنی و کارآیی نیز افزایش می یابد. علاوه بر این ، با افزایش خطر ، مزایای بالقوه برای بیمار نیز باید افزایش یابد.
کشف آنچه که طبق استانداردهای مدرن یک وسیله پزشکی تلقی می شود ، به قرن قبل برمی گردد. ۷۰۰۰ سال قبل از میلاد در بلوچستان جایی که دندانپزشکان دوره نوسنگی از مته های نوک چخماقی و بندهای کمانی استفاده می کردند.
مطالعه باستان شناسی و ادبیات پزشکی رومی همچنین نشان می دهد که بسیاری از انواع تجهیزات پزشکی در زمان روم باستان در حال استفاده گسترده بوده است.
در ایالات متحده تا زمانی که قانون غذا ، دارو و لوازم آرایشی فدرال (FD&C Act) در سال ۱۹۳۸ تنظیم نشده بود ، تجهیزات پزشکی تحت نظارت قرار گرفت. بعداً در سال ۱۹۷۶ ، اصلاحات دستگاه پزشکی در قانون FD&C مقررات و نظارت بر تجهیزات پزشکی را به عنوان امروزه در ایالات متحده تعیین کرد.مقررات مربوط به تجهیزات پزشکی در اروپا به گونه ای که امروزه می شناسیم ، در سال ۱۹۹۳ توسط آنچه که در مجموع به عنوان دستورالعمل تجهیزات پزشکی (MDD) شناخته می شود ، اجرا شد. در ۲۶ مه ۲۰۱۷ ، مقررات تجهیزات پزشکی (MDR) جایگزین MDD شد.
وسایل پزشکی هم از نظر کاربرد و هم از نظر علائم استفاده متفاوت است. مثالها از دستگاههای ساده و کم خطر مانند داروهای ضد افسردگی زبان ، دماسنجهای پزشکی ، دستکشهای یکبار مصرف و روتختی گرفته تا وسایل پیچیده و پرخطر که کاشته می شوند و عمر را حفظ می کنند. یکی از نمونه های دستگاه های پرخطر ، آنهایی هستند که دارای نرم افزار تعبیه شده مانند ضربان ساز هستند و در انجام آزمایشات پزشکی ، ایمپلنت ها و پروتزها کمک می کنند. طراحی تجهیزات پزشکی بخش عمده ای از مهندسی پزشکی را تشکیل می دهد.
بازار جهانی تجهیزات پزشکی در سال ۲۰۰۶ به ۲۰۹ میلیارد دلار رسیدو در سال ۲۰۱۳ بین ۲۲۰ تا ۲۵۰ میلیارد دلار برآورد شد.
ایالات متحده ۴۰ ~ از بازار جهانی را کنترل می کند و پس از آن اروپا (۲۵)) ، ژاپن (۱۵)) و بقیه جهان (۲۰)) در اختیار دارند. اگرچه در مجموع اروپا سهم بیشتری دارد ، ژاپن دومین سهم بازار کشور بزرگ را دارد. بزرگترین سهم بازار در اروپا (به ترتیب اندازه سهم بازار) متعلق به آلمان ، ایتالیا ، فرانسه و انگلستان است. بقیه جهان شامل مناطقی مانند (بدون ترتیب خاصی) استرالیا ، کانادا ، چین ، هند و ایران است. این مقاله به بحث در مورد وسایل پزشکی در این مناطق مختلف می پردازد و در طول مقاله این مناطق به ترتیب سهم بازار جهانی آنها مورد بحث قرار می گیرد.
تعریف
ارائه تعریف جهانی برای تجهیزات پزشکی دشوار است زیرا نهادهای نظارتی متعددی در سراسر جهان بر بازاریابی تجهیزات پزشکی نظارت می کنند. اگرچه این نهادها اغلب با یکدیگر همکاری می کنند و به طور کلی در مورد این بحث بحث می کنند ، اما تفاوت های ظریفی در واژه ها وجود دارد که مانع از هماهنگی جهانی تعریف دستگاه پزشکی می شود ، بنابراین تعریف مناسب از یک دستگاه پزشکی بستگی به منطقه دارد. اغلب بخشی از تعریف دستگاه پزشکی برای تمایز بین دستگاه های پزشکی و داروها در نظر گرفته شده است ، زیرا الزامات نظارتی این دو متفاوت است. تعاریف نیز اغلب تشخیص آزمایشگاهی را به عنوان زیر گروهی از تجهیزات پزشکی تشخیص می دهند و لوازم جانبی را به عنوان وسایل پزشکی تعیین می کنند.
تعاریف بر اساس منطقه
ایالات متحده (سازمان غذا و دارو)
بخش ۲۰۱ (ساعت) قانون فدرال دارویی و آرایشی و بهداشتی (FD&C)دستگاه را به عنوان “ابزار ، دستگاه ، دستگاه ، دستگاه ، ساخت ، کاشت ، معرف آزمایشگاهی یا سایر مقاله های مشابه یا مرتبط ، از جمله قسمت جزء یا لوازم جانبی که عبارتند از:
در فرمول رسمی ملی یا فارماکوپه ایالات متحده یا هرگونه مکمل آنها به رسمیت شناخته شده است
برای استفاده در تشخیص بیماری یا سایر شرایط ، یا در درمان ، کاهش ، درمان یا پیشگیری از بیماری ، در انسان یا حیوانات دیگر ، یا
در نظر گرفته شده است که بر ساختار یا عملکرد بدن انسان یا سایر حیوانات تأثیر می گذارد و
که از طریق اعمال شیمیایی در بدن انسان یا سایر حیوانات به اهداف مورد نظر اولیه خود نمی رسد و برای دستیابی به اهداف اصلی مورد نظر متابولیزه نمی شود. اصطلاح “دستگاه” شامل عملکردهای نرم افزاری نیست که طبق بند ۵۲۰ (o) حذف شده اند. “
اتحادیه اروپا
طبق ماده ۱ دستورالعمل شورا ۹۳/۴۲/EEC ، [۷] منظور از “وسیله پزشکی” هرگونه “ابزار ، دستگاه ، دستگاه ، نرم افزار ، مواد یا سایر اقلام است ، چه به تنهایی یا به صورت ترکیبی استفاده شود ، از جمله نرم افزارهای مورد نظر سازنده آن به طور خاص برای اهداف تشخیصی و/یا درمانی مورد استفاده قرار گیرد و برای کاربرد مناسب آن ضروری است ، که توسط سازنده در نظر گرفته شده است تا برای انسان به منظور موارد زیر استفاده شود:
- تشخیص ، پیشگیری ، نظارت ، درمان یا کاهش بیماری ،
- تشخیص ، نظارت ، درمان ، کاهش یا جبران آسیب یا نقص ،
- بررسی ، جایگزینی یا اصلاح آناتومی یا یک فرایند فیزیولوژیکی ،
- کنترل تصور
و که از طریق داروسازی ، ایمونولوژیکی یا متابولیک به فعالیت اصلی مورد نظر خود یا بر روی بدن انسان دست نیافته است ، اما ممکن است با چنین وسایلی در عملکرد آن کمک شود.
چارچوب حقوقی اتحادیه اروپا
بر اساس رویکرد جدید ، قوانین مربوط به ایمنی و عملکرد دستگاه های پزشکی در دهه ۱۹۹۰ در اتحادیه اروپا هماهنگ شد. رویکرد جدید ، که در قطعنامه شورای اروپا در ماه مه ۱۹۸۵ [۸] تعریف شده است ، نشان دهنده روش نوآورانه هماهنگی فنی است. هدف از بین بردن موانع فنی تجارت و رفع عدم قطعیت برای فعالان اقتصادی و تسهیل جابجایی آزاد کالا در داخل اتحادیه اروپا است.
چهارچوب قانونی قبلی شامل سه دستورالعمل بود:
- دستورالعمل ۹۰/۳۸۵/EEC در مورد تجهیزات پزشکی قابل کاشت فعال
- دستورالعمل ۹۳/۴۲/EEC در مورد تجهیزات پزشکی
- دستورالعمل ۹۸/۷۹/EC در مورد دستگاههای تشخیصی آزمایشگاهی آزمایشگاهی (تا سال ۲۰۲۲ ، مقررات تشخیص آزمایشگاهی (IVDR) جایگزین دستورالعمل کنونی اتحادیه اروپا در زمینه تشخیص آزمایشگاهی (۹۸/۷۹/EC) خواهد شد.
- هدف آنها تضمین سطح بالای حفاظت از سلامت و ایمنی انسان و عملکرد خوب بازار واحد است. این سه دستورالعمل اصلی در طول زمان توسط چندین دستورالعمل اصلاح و اجرا ، از جمله آخرین بازنگری فنی که توسط بخشنامه ۲۰۰۷/۴۷ EC ایجاد شده است ، تکمیل شده است.
دولت هر کشور عضو باید یک مرجع صالح مسئول دستگاه های پزشکی تعیین کند. مرجع صالح (CA) نهادی با اختیار است که به نمایندگی از کشور عضو عمل می کند تا اطمینان حاصل شود که دولت کشور عضو الزامات دستورالعمل های تجهیزات پزشکی را به قوانین ملی منتقل کرده و آنها را اعمال می کند. CA به وزیر بهداشت در کشور عضو گزارش می دهد. CA در یک کشور عضو هیچ صلاحیت قضایی در هیچ کشور دیگری ندارد ، اما اطلاعات را مبادله می کند و سعی می کند به مواضع مشترک برسد.
به عنوان مثال ، در انگلستان ، آژانس تنظیم کننده داروها و محصولات بهداشتی (MHRA) به عنوان CA عمل می کرد. در ایتالیا این وزیر وزیر سلام است (وزارت بهداشت) دستگاه های پزشکی نباید با محصولات دارویی اشتباه گرفته شوند. در اتحادیه اروپا ، همه دستگاه های پزشکی باید با علامت CE شناسایی شوند. انطباق یک دستگاه پزشکی متوسط یا پرخطر با مقررات مربوطه نیز توسط یک نهاد خارجی ، بدن ابلاغ شده ، قبل از عرضه در بازار ارزیابی می شود.
در سپتامبر ۲۰۱۲ ، کمیسیون اروپا قوانین جدیدی را با هدف افزایش ایمنی ، قابلیت ردیابی و شفافیت پیشنهاد کرد.این آیین نامه در سال ۲۰۱۷ تصویب شد.
چارچوب حقوقی اصلی آینده شامل دو مقرره است که جایگزین سه دستورالعمل قبلی شده است:
مقررات تجهیزات پزشکی (MDR (EU) 2017/745)
مقررات دستگاه های پزشکی تشخیصی آزمایشگاهی (IVDR (EU) 2017/746)
ژاپن
ماده ۲ ، پاراگراف ۴ ، قانون امور دارویی (PAL) [11] دستگاه های پزشکی را اینگونه تعریف می کند: “ابزارها و دستگاه هایی که برای تشخیص ، درمان یا پیشگیری از بیماری ها در انسان یا سایر حیوانات مورد استفاده قرار می گیرند و قصد دارند بر ساختار یا عملکردهای آنها تأثیر بگذارند. بدن انسان یا حیوانات دیگر. “
بقیه دنیا

کانادا
اصطلاح دستگاه پزشکی ، همانطور که در قانون مواد غذایی و دارویی تعریف شده است ، عبارت است از “هرگونه مقاله ، ابزار ، دستگاه یا وسیله ای شامل هرگونه جزء ، قسمت یا لوازم جانبی آن ، تولید ، فروش یا نمایندگی برای استفاده در: تشخیص ، درمان ، کاهش یا پیشگیری از بیماری ، اختلال یا وضعیت جسمی غیر عادی یا علائم آن در انسان ؛ ترمیم ، اصلاح یا اصلاح عملکرد بدن یا ساختار بدن انسان ؛ تشخیص بارداری در انسان ؛ یا مراقبت از یک انسان در دوران بارداری و هنگام و بعد از تولد کودک ، از جمله مراقبت از کودک. این شامل یک وسیله پیشگیری از بارداری است اما شامل یک دارو نمی شود.
این اصطلاح طیف وسیعی از ابزارهای بهداشتی یا پزشکی را که در درمان ، کاهش ، تشخیص یا پیشگیری از بیماری یا شرایط جسمی غیر طبیعی استفاده می شود ، شامل می شود. بهداشت کانادا قبل از صدور مجوز فروش آنها در کانادا ، دستگاه های پزشکی را برای ارزیابی ایمنی ، اثربخشی و کیفیت آنها بررسی می کند.طبق قانون ، دستگاه پزشکی شامل هیچ وسیله ای نیست که برای استفاده در مورد حیوانات در نظر گرفته شود. “
مقررات و نظارت
طبقه بندی ریسک
مقامات نظارتی کلاس های مختلف دستگاه های پزشکی را بر اساس پتانسیل آنها برای آسیب در صورت سوء استفاده ، پیچیدگی طراحی و ویژگی های استفاده از آنها تشخیص می دهند. هر کشور یا منطقه ای این دسته ها را به روش های مختلف تعریف می کند. مقامات همچنین تشخیص می دهند که برخی از دستگاه ها در ترکیب با داروها ارائه می شوند و تنظیم این محصولات ترکیبی این عامل را در نظر می گیرد.
طبقه بندی دستگاه های پزشکی بر اساس خطر آنها برای حفظ ایمنی بیمار و کارکنان در عین تسهیل بازاریابی محصولات پزشکی ضروری است. با ایجاد طبقه بندی های مختلف ریسک ، دستگاه های کم خطر ، به عنوان مثال ، گوشی پزشکی یا افسردگی زبان ، ملزم به آزمایش مشابهی نیستند که دستگاه های پرخطر مانند ضربان سازهای مصنوعی تحت آن قرار می گیرند. ایجاد سلسله مراتب طبقه بندی ریسک به نهادهای نظارتی اجازه می دهد تا هنگام بازبینی دستگاه های پزشکی ، انعطاف پذیری را ارائه دهند.
ایالات متحده
بر اساس قانون غذا ، دارو و آرایشی ، اداره غذا و داروی ایالات متحده بر اساس سطح کنترل لازم برای اطمینان از ایمنی و اثربخشی ، سه گروه از تجهیزات پزشکی را به رسمیت می شناسد.
کلاس I
کلاس دوم
کلاس سوم
روشهای طبقه بندی در کد مقررات فدرال ، عنوان ۲۱ ، قسمت ۸۶۰ (معمولاً به عنوان ۲۱ CFR 860 شناخته می شود) توضیح داده شده است.
دستگاههای کلاس I تحت حداقل کنترل نظارتی هستند و قصد ندارند به حمایت یا تداوم زندگی کمک کنند یا در پیشگیری از آسیب به سلامت انسانها اهمیت بسزایی داشته باشند و ممکن است خطر بی دلیل بیماری یا جراحت را ایجاد نکنند.نمونه هایی از دستگاه های کلاس I شامل باندهای الاستیک ، دستکش معاینه و ابزار جراحی دستی است.
دستگاه های کلاس II مشمول الزامات ویژه برچسب زنی ، استانداردهای عملکرد اجباری و نظارت پس از فروش می شوند.نمونه هایی از دستگاه های کلاس II شامل سوزن های طب سوزنی ، ویلچرهای برقی ، پمپ های تزریق ، دستگاه های تصفیه هوا ، پرده های جراحی ، سیستم های ناوبری کلیشه ای و روبات های جراحی است.
وسایل کلاس III معمولاً آنهایی هستند که زندگی انسان را پشتیبانی یا حفظ می کنند ، در پیشگیری از اختلال در سلامت انسان اهمیت بسزایی دارند ، یا خطر بالقوه و غیر منطقی بیماری یا جراحت را ارائه می دهند و نیاز به تأیید پیش از بازار دارند.نمونه هایی از دستگاه های کلاس III شامل ضربان ساز قابل کاشت ، تولید کننده نبض ، آزمایشات تشخیص HIV ، دفیبریلاتورهای خودکار خارجی و ایمپلنت های داخل استخوانی است.
اتحادیه اروپا (اتحادیه اروپا) و انجمن تجارت آزاد اروپا (EFTA)
طبقه بندی دستگاه های پزشکی در اتحادیه اروپا در ماده IX دستورالعمل شورا ۹۳/۴۲/EEC و ضمیمه VIII مقررات دستگاه های پزشکی اتحادیه اروپا مشخص شده است. اساساً چهار کلاس وجود دارد ، از ریسک کم تا ریسک بالا ، کلاس های I ، IIa ، IIb و III (این شامل تشخیص در شرایط آزمایشگاهی از جمله نرم افزار نیست ، که در چهار کلاس طبقه بندی می شوند: از A (کم خطر) تا D (بالاترین خطر) ): [۲۲]
کلاس I (شامل I عقیم ، I با عملکرد اندازه گیری ، و کلاس I ابزارهای قابل استفاده مجدد جراحی)
کلاس IIa
کلاس IIb
کلاس سوم
مجوز دستگاه های پزشکی با اعلامیه انطباق تضمین می شود. این اظهارنامه توسط خود سازنده صادر می شود ، اما برای محصولات کلاس Is ، Im ، Ir ، IIa ، IIb یا III ، باید توسط گواهی انطباق صادر شده توسط یک نهاد اعلام شده تأیید شود. یک سازمان ابلاغ شده یک سازمان دولتی یا خصوصی است که برای تأیید انطباق دستگاه با دستورالعمل اروپایی معتبر است. دستگاههای پزشکی مربوط به کلاس I (به شرطی که نیازی به عقیم سازی نداشته باشند یا عملکردی را اندازه گیری نکنند) را می توان صرفاً با تأیید خود به بازار عرضه کرد.
طبقه بندی اروپایی به قواعدی بستگی دارد که شامل مدت زمان تماس دستگاه با بدن ، ویژگی تهاجمی ، استفاده از منبع انرژی ، تأثیر بر گردش خون مرکزی یا سیستم عصبی ، تأثیر تشخیصی یا ترکیب یک محصول دارویی است. وسایل پزشکی دارای مجوز باید دارای علامت CE روی بسته بندی ، بروشورها و غیره باشند. این بسته ها همچنین باید پیکتوگرام های هماهنگ و نشان های استاندارد EN را نشان دهند تا ویژگی های ضروری مانند دستورالعمل استفاده ، تاریخ انقضا ، سازنده ، استریل ، مجدد استفاده نشود. ، و غیره.
در نوامبر ۲۰۱۸ دادگاه اداری فدرال سوئیس تصمیم گرفت که برنامه “Sympto” ، که برای تجزیه و تحلیل چرخه قاعدگی زنان استفاده می شود ، یک دستگاه پزشکی است زیرا با استفاده از داده های شخصی پنجره باروری را برای هر زن محاسبه می کند. سازنده ، Sympto-Therm Foundation ، استدلال کرد که این یک روش آموزشی است نه یک فرایند پزشکی. دادگاه تصریح کرد که اگر برنامه ای است که برای هر یک از اهداف پزشکی مقرر در قانون استفاده می شود ، یک ابزار پزشکی است و با محاسبه یا مقایسه اطلاعات سلامتی را ایجاد یا اصلاح می کند و اطلاعات مربوط به یک بیمار را ارائه می دهد.
ژاپن
دستگاه های پزشکی (به استثنای تشخیص آزمایشگاهی) در ژاپن بر اساس خطر به چهار گروه طبقه بندی می شوند:
کلاس I
کلاس دوم
کلاس سوم
کلاس چهارم
کلاسهای I و II بین دستگاههای بسیار کم خطر و کم خطر تمایز قائل می شوند. کلاسهای III و IV ، به ترتیب با ریسک متوسط و بالا ، از تجهیزات پزشکی بسیار کنترل شده و ویژه هستند. تشخیص های آزمایشگاهی دارای سه طبقه بندی خطر است.
برای مناطق باقیمانده در جهان ، طبقه بندی ریسک ها عموماً شبیه ایالات متحده ، اتحادیه اروپا و ژاپن است یا نوعی از ترکیب دو یا چند طبقه بندی ریسک از سه کشور است.
استرالیا
طبقه بندی دستگاه های پزشکی در استرالیا در بخش ۴۱BD قانون کالاهای درمانی ۱۹۸۹ و مقررات ۳٫۲ مقررات کالاهای درمانی ۲۰۰۲ ، تحت کنترل اداره کالاهای درمانی بیان شده است. به طور مشابه با طبقه بندی اتحادیه اروپا ، آنها به ترتیب افزایش ریسک و سطح کنترل مورد نیاز در چند دسته قرار می گیرند. قوانین مختلف طبقه بندی دستگاه
اداره تجهیزات پزشکی کانادا چهار گروه از تجهیزات پزشکی را بر اساس سطح کنترل لازم برای اطمینان از ایمنی و اثربخشی دستگاه به رسمیت می شناسد. دستگاه های کلاس I کمترین خطر بالقوه را دارند و نیازی به مجوز ندارند. دستگاه های کلاس II به ایمنی و اثربخشی دستگاه به اظهارات سازنده نیاز دارند ، در حالی که دستگاه های کلاس III و IV خطرات بالقوه بیشتری را ارائه می دهند و مورد بررسی دقیق قرار می گیرند. سند راهنمای طبقه بندی دستگاه ها توسط Health Canada منتشر می شود.
کانادا
کلاس های کانادایی دستگاه های پزشکی مطابق با دستورالعمل شورای اروپا ۹۳/۴۲/EEC (MDD) است:
- کلاس I (کانادا) به طور کلی با کلاس I (ECD) مطابقت دارد
- کلاس II (کانادا) به طور کلی با کلاس IIa (ECD) مطابقت دارد
- کلاس III (کانادا) به طور کلی با کلاس IIb (ECD) مطابقت دارد
- کلاس IV (کانادا) به طور کلی با کلاس III (ECD) مطابقت دارد
به عنوان مثال می توان به ابزارهای جراحی (کلاس I) ، لنزهای تماسی و اسکنرهای اولتراسوند (کلاس II) ، ایمپلنت های ارتوپدی و دستگاه های همودیالیز (کلاس III) و ضربان ساز قلب (کلاس IV) اشاره کرد.
ایران
ایران حدود ۲۰۰۰ نوع تجهیزات پزشکی و ملزومات پزشکی مانند لوازم خانگی ، وسایل دندانپزشکی ، اقلام پزشکی یکبار مصرف استریل ، ماشین های آزمایشگاهی ، مواد زیستی مختلف و ایمپلنت های دندانی تولید می کند. ۴۰۰ محصول پزشکی در رده خطر C و D تولید می شود که همه آنها از نظر ایمنی و عملکرد بر اساس استانداردهای اتحادیه اروپا دارای مجوز از وزارت بهداشت ایران هستند.
برخی از تجهیزات پزشکی ایرانی مطابق با استانداردهای اتحادیه اروپا تولید می شوند.
برخی از تولیدکنندگان در ایران دستگاه ها و لوازم پزشکی را که مطابق با استانداردهای اتحادیه اروپا هستند به کشورهای متقاضی از جمله ۴۰ کشور آسیایی و اروپایی صادر می کنند.
برخی از تولیدکنندگان ایرانی محصولات خود را به کشورهای خارجی صادر می کنند.
استانداردسازی و نگرانی های نظارتی
استانداردهای ISO دستگاه های پزشکی توسط ICS 11.100.20 و ۱۱٫۰۴۰٫۰۱ پوشش داده شده است.مدیریت کیفیت و ریسک در مورد این موضوع برای اهداف نظارتی توسط ISO 13485 و ISO 14971 انجام شده است. ISO 13485: 2016 برای همه ارائه دهندگان و تولیدکنندگان تجهیزات پزشکی ، اجزاء ، خدمات قراردادی و توزیع کنندگان تجهیزات پزشکی قابل اجرا است. این استاندارد مبنای رعایت مقررات در بازارهای محلی و اکثر بازارهای صادراتی است.علاوه بر این ، ISO 9001: 2008 اولویت دارد زیرا نشان می دهد که شرکت در ایجاد محصولات جدید مشارکت دارد. مستلزم این است که توسعه محصولات تولیدی قبل از توزیع محصول دارای یک فرآیند تأیید و مجموعه ای از استانداردهای دقیق کیفیت و سوابق توسعه باشد.استانداردهای بیشتر عبارتند از IEC 60601-1 که برای دستگاههای الکتریکی (از منبع تغذیه اصلی و باتری) ، EN 45502-1 که برای دستگاههای پزشکی قابل کاشت فعال و IEC 62304 برای نرم افزارهای پزشکی است. FDA ایالات متحده همچنین مجموعه ای از راهنمایی ها را برای صنعت در رابطه با این موضوع در برابر ۲۱ CFR 820 زیر فصل H – دستگاه های پزشکی منتشر کرد.زیرگروه B شامل الزامات سیستم با کیفیت است که یکی از اجزای مهم آن کنترل های طراحی است (۲۱ CFR 820.30). برای برآوردن خواسته های این استانداردهای مقررات صنعت ، تعداد فزاینده ای از توزیع کنندگان تجهیزات پزشکی فرآیند مدیریت شکایات را در سرلوحه اقدامات مدیریت کیفیت خود قرار می دهند. این رویکرد خطرات را کاهش می دهد و دید مسائل مربوط به کیفیت را افزایش می دهد.
از اواخر دهه ۱۹۸۰ FDA مشارکت خود را در بررسی توسعه نرم افزار دستگاه های پزشکی افزایش داد. عامل اصلی تغییر دستگاه پرتودرمانی (Therac-25) بود که به دلیل خطاهای برنامه نویسی نرم افزار ، بیماران را بیش از حد مصرف می کرد. [۳۸] FDA اکنون بر نظارت نظارتی بر روند توسعه نرم افزار دستگاه های پزشکی و آزمایش سطح سیستم متمرکز است.
مطالعه ای در سال ۲۰۱۱ توسط دکتر دیانا زاکرمن و پل براون از مرکز ملی تحقیقات سلامت و دکتر استیون نیسن از کلینیک کلیولند ، که در آرشیو طب داخلی منتشر شد ، نشان داد که اکثر دستگاه های پزشکی در پنج سال گذشته برای ” مشکلات جدی سلامتی یا مرگ “قبلا توسط FDA با استفاده از روش کمتر دقیق و ارزان تر ۵۱۰ (k) تأیید شده بود. در موارد معدودی ، این دستگاه ها بسیار کم خطر تلقی می شدند ، در حالی که هیچ گونه بازنگری نظارتی FDA را انجام ندادند. از ۱۱۳ دستگاه فراخوانده ، ۳۵ دستگاه مربوط به مشکلات قلبی عروقی بود. [۴۰] این مطالعه موضوع جلسات کنگره برای ارزیابی مجدد روشها و نظارت FDA بود.
مطالعه ای که در سال ۲۰۱۴ توسط دکتر دیانا زاکرمن ، پل براون و دکتر آدیتی داس از مرکز ملی تحقیقات سلامت انجام شد و در JAMA Internal Medicine منتشر شد ، شواهد علمی موجود در مورد ایمپلنت های پزشکی که توسط FDA 510 پاکسازی شده است را در دسترس عموم قرار داد. ک) روند از سال ۲۰۰۸ تا ۲۰۱۲٫ آنها دریافتند که شواهد علمی که از “معادل سازی قابل توجه” با سایر دستگاه های موجود در بازار پشتیبانی می کند ، طبق قانون لازم است در دسترس عموم قرار گیرد ، اما این اطلاعات فقط برای ۱۶ of از ایمپلنت های تصادفی انتخاب شده در دسترس بود و فقط ۱۰ داده های بالینی ارائه کرده است. از بیش از ۱۱۰۰ ایمپلنت اولیه که ایمپلنت های جدید به طور قابل ملاحظه ای معادل آن بودند ، تنها ۳٪ دارای شواهد علمی عمومی و فقط ۱٪ شواهد بالینی ایمنی یا اثربخشی بودند. [۴۱] محققان به این نتیجه رسیدند که شواهد علمی در دسترس عموم در مورد ایمپلنت ها برای محافظت از سلامت عمومی مورد نیاز است.
در سال ۲۰۱۴-۲۰۱۵ ، یک توافقنامه بین المللی جدید ، برنامه حسابرسی واحد تجهیزات پزشکی (MDSAP) ، با پنج کشور شرکت کننده: استرالیا ، برزیل ، کانادا ، ژاپن و ایالات متحده امضا شد. هدف از این برنامه “توسعه فرایندی بود که به یک ممیزی واحد یا بازرسی اجازه می داد تا اطمینان حاصل شود که الزامات نظارتی دستگاه پزشکی برای هر پنج کشور برآورده شده است.
در سال ۲۰۱۷ ، مطالعه ای توسط دکتر جی رونکیلو و دکتر دایانا زاکرمن در مجله سیاست گذاری معتبر Milbank Quarterly منتشر شد که نشان داد پرونده الکترونیکی سلامت و سایر نرم افزارهای دستگاه به دلیل نقص های تهدید کننده زندگی فراخوانده می شوند. این مقاله با اشاره به عدم وجود ضمانت در برابر هک و سایر تهدیدات امنیت سایبری ، اظهار داشت: “مقررات فعلی لازم است اما برای اطمینان از ایمنی بیمار با شناسایی و از بین بردن نقص های خطرناک در نرم افزارهای موجود در بازار کافی نیست”. [۴۳] آنها افزودند که تغییرات قانونی ناشی از قانون تحت عنوان قانون قرن بیست و یکم “فناوری اطلاعات بهداشتی را بیشتر خارج می کند ، ضمانت هایی را کاهش می دهد که گزارش و یادآوری به موقع نرم افزارهای پزشکی معیوب را که می تواند به بیماران آسیب برساند ، تسهیل می کند”.
در مطالعه ای که توسط دکتر استفانی فاکس رولینگ و همکارانش در مرکز ملی تحقیقات سلامت انجام شد ، در سال ۲۰۱۸ در مجله سیاست گذاری Milbank Quarterly منتشر شد ، بررسی شد که آیا مطالعاتی که توسط FDA برای دستگاه های پزشکی پرخطر بررسی شده است برای زنان بی خطر و م effectiveثر است ، اقلیت ها یا بیماران بالای ۶۵ سال. [۴۴] این قانون تنوع بیماران را در آزمایشات بالینی ارائه شده برای FDA برای بررسی تشویق می کند ، اما نیازی به آن ندارد. در این مطالعه مشخص شد که اکثر دستگاه های پزشکی پرخطر مورد آزمایش و تجزیه و تحلیل قرار نمی گیرند تا اطمینان حاصل شود که آنها برای همه گروه های اصلی جمعیتی ، به ویژه اقلیت های نژادی و قومی و افراد بالای ۶۵ سال ، بی خطر و م effectiveثر هستند. بنابراین ، آنها اطلاعاتی در مورد ایمنی یا اثربخشی ارائه نمی دهند. این به بیماران و پزشکان کمک می کند تا تصمیمات آگاهانه ای بگیرند.
در سال ۲۰۱۸ ، تحقیقی با حضور روزنامه نگاران در ۳۶ کشور جهان که توسط کنسرسیوم بین المللی روزنامه نگاران تحقیقی (ICIJ) هماهنگ شده بود ، باعث ایجاد اصلاحاتی در ایالات متحده شد ، به ویژه در حدود ۵۱۰ (k) فرایند معادل سازی اساسی.
بریتانیا و اتحادیه اروپا.
استانداردهای بسته بندی
بسته بندی دستگاه های پزشکی بسیار مقرر شده است. اغلب وسایل و محصولات پزشکی در بسته استریل می شوند. [۴۷] عقیم سازی باید در طول توزیع حفظ شود تا امکان استفاده فوری توسط پزشکان فراهم شود. مجموعه ای از آزمایشات بسته بندی ویژه ، توانایی بسته بندی را برای حفظ نازایی اندازه گیری می کند. استانداردهای مربوطه عبارتند از:
ASTM F2097 – راهنمای استاندارد برای طراحی و ارزیابی بسته بندی انعطاف پذیر اولیه برای محصولات پزشکی
ASTM F2475-11-راهنمای استاندارد برای ارزیابی سازگاری زیستی مواد بسته بندی تجهیزات پزشکی [۴۸]
EN 868 مواد و سیستم های بسته بندی برای تجهیزات استریل شده پزشکی ، الزامات عمومی و روش های آزمایش
ISO 11607 بسته بندی برای دستگاههای پزشکی استریل شده
آزمایش بسته بخشی از یک سیستم مدیریت کیفیت شامل تأیید و اعتبار سنجی است. مستندسازی و اطمینان از مطابقت بسته ها با مقررات و الزامات استفاده نهایی بسیار مهم است. برای اطمینان از عملکرد یکنواخت ، فرآیندهای تولید باید کنترل و تأیید شوند. [۴۹] [۵۰] EN ISO 15223-1 نمادهایی را تعریف می کند که می توانند برای انتقال اطلاعات مهم در مورد بسته بندی و برچسب زدن استفاده شوند.
استانداردهای زیست سازگاری
ISO 10993 – ارزیابی بیولوژیکی تجهیزات پزشکی
استانداردهای نظافت
از سال ۲۰۰۰ ، هنگامی که ارتوپدی سولزر چندین هزار ایمپلنت لگن فلزی را که دارای بقایای تولیدی بودند ، فراخوانی کرد ، نظافت دستگاه های پزشکی مورد توجه بیشتری قرار گرفت. [۵۱] بر اساس این رویداد ، ASTM یک گروه وظیفه جدید (F04.15.17) برای روشهای آزمایش ، اسناد راهنما و سایر استانداردها برای رسیدگی به پاکیزگی وسایل پزشکی ایجاد کرد. این گروه وظیفه تا کنون دو استاندارد برای ایمپلنت دائمی صادر کرده است: ۱٫ ASTM F2459: روش آزمون استاندارد برای استخراج باقی مانده از اجزای پزشکی فلزی و تعیین مقدار از طریق تجزیه و تحلیل اندازه گیری وزن [۵۲] ۲٫ ASTM F2847: Standard Practice for Reporting and Assessment of Resides on ایمپلنت های یکبار مصرف [۵۳] ۳٫ ASTM F3172: راهنمای استاندارد برای اعتبار سنجی فرآیندهای تمیزکاری مورد استفاده در هنگام تولید تجهیزات پزشکی [۵۴]
علاوه بر این ، پاکیزگی دستگاه های قابل استفاده مجدد منجر به مجموعه ای از استانداردها شده است ، از جمله:
- ASTM E2314: روش آزمایشی استاندارد برای تعیین اثربخشی فرآیندهای تمیز کردن وسایل پزشکی قابل استفاده مجدد با استفاده از روش میکروبیولوژیکی (آزمایش استفاده شبیه سازی شده)
- ASTM D7225: راهنمای استاندارد برای کارآیی پاکسازی خون مواد شوینده و ضدعفونی کننده های واشر
- ASTM F3208: راهنمای استاندارد برای انتخاب خاکهای آزمایشی برای اعتبار سنجی روشهای تمیز کردن برای تجهیزات پزشکی قابل استفاده مجدد
گروه کاری ASTM F04.15.17 بر روی چندین استاندارد جدید کار می کند که شامل طراحی ایمپلنت برای تمیز کردن ، انتخاب و آزمایش برس برای تمیز کردن دستگاه های قابل استفاده مجدد و ارزیابی تمیز کردن تجهیزات پزشکی ساخته شده توسط تولید مواد افزودنی است.علاوه بر این ، FDA دستورالعمل های جدیدی را برای پردازش مجدد دستگاه های پزشکی قابل استفاده مجدد ، مانند تراشیدن ارتوسکوپی ، آندوسکوپ ها و لوله های مکنده ایجاد می کند.تحقیقات جدیدی در ACS Applied Interfaces and Material منتشر شد تا عاری از عوامل بیماری زا برای ابزارهای پزشکی باشد.
طراحی ، نمونه سازی و توسعه محصول
تولید تجهیزات پزشکی با توجه به طبقه بندی دستگاه نیاز به سطح کنترل فرایند دارد. ریسک بالاتر ؛ کنترل های بیشتر هنگامی که در مرحله تحقیق و توسعه اولیه بودیم ، تولیدکنندگان اکنون در حال طراحی برای قابلیت تولید هستند. این بدان معناست که می توان محصولات را با دقت بیشتری مهندسی کرد تا تولید آنها منجر به زمان کوتاه تر ، تحمل بیشتر و مشخصات و نمونه های پیشرفته تر شود. این روزها ، با کمک CAD یا سیستم عامل های مدل سازی ، کار اکنون بسیار سریعتر است و این می تواند به عنوان ابزاری برای ایجاد طراحی استراتژیک و همچنین یک ابزار بازاریابی عمل کند.
عدم دستیابی به اهداف هزینه منجر به ضررهای قابل توجهی برای یک سازمان می شود. علاوه بر این ، با رقابت جهانی ، تحقیق و توسعه دستگاه های جدید تنها یک ضرورت نیست ، بلکه برای تولید کنندگان تجهیزات پزشکی ضروری است. تحقق یک طرح جدید می تواند بسیار پرهزینه باشد ، به ویژه با چرخه عمر کوتاه تر محصول. با پیشرفت تکنولوژی ، معمولاً سطحی از کیفیت ، ایمنی و قابلیت اطمینان وجود دارد که با گذشت زمان به طور تصاعدی افزایش می یابد.
به عنوان مثال ، مدلهای اولیه ضربان ساز مصنوعی دستگاههای پشتیبانی خارجی بودند که پالسهای الکتریسیته را از طریق الکترودهای روی قفسه سینه به عضلات قلب منتقل می کرد. الکترودها مستقیماً از طریق قفسه سینه با قلب تماس می گیرند و به پالس های تحریک اجازه می دهند از بدن عبور کنند. دریافت کنندگان این نوع عفونت معمولاً در ورودی الکترودها دچار عفونت می شوند که منجر به آزمایش بعدی اولین ضربان ساز داخلی با الکترودهایی می شود که توسط توراکوتومی به میوکارد متصل شده اند. تحولات آینده منجر به منبع قدرت ایزوتوپ شد که برای طول عمر بیمار باقی می ماند.
برنامه های پزشکی موبایل:
با افزایش استفاده از تلفن های هوشمند در فضای پزشکی ، در سال ۲۰۱۳ ، FDA مقررات برنامه های پزشکی تلفن همراه و محافظت از کاربران در برابر استفاده ناخواسته آنها را صادر کرد ، که به زودی توسط اتحادیه اروپا و سایر نهادهای نظارتی دنبال شد. این راهنما برنامه هایی را که بر اساس ادعاهای بازاریابی برنامه ها تحت نظارت هستند ، متمایز می کند. [۶۱] گنجاندن دستورالعمل ها در مرحله توسعه چنین برنامه هایی را می توان توسعه دستگاه پزشکی در نظر گرفت. مقررات باید تطبیق داده شود و ممکن است به دلیل ماهیت “نسخه های” توسعه برنامه های تلفن همراه ، پیشنهاداتی برای تسریع در تأیید مورد نیاز باشد. [۶۲] [۶۳]
در ۲۵ سپتامبر ۲۰۱۳ ، FDA پیش نویس سند راهنمایی برای تنظیم برنامه های پزشکی تلفن همراه را منتشر کرد تا روشن شود که چه نوع برنامه های تلفن همراه مرتبط با سلامتی تحت نظارت قرار نمی گیرند و کدام برنامه خواهد بود.
امنیت سایبری
دستگاه های پزشکی مانند ضربان ساز ، پمپ انسولین ، مانیتور اتاق عمل ، دفیبریلاتور و ابزارهای جراحی ، از جمله محرک های عمیق مغز ، می توانند توانایی انتقال اطلاعات حیاتی سلامت را از بدن بیمار به متخصصان پزشکی داشته باشند.برخی از این دستگاه ها را می توان از راه دور کنترل کرد. این امر باعث نگرانی در مورد مسائل مربوط به حریم خصوصی و امنیت ،خطای انسانی و اشکالات فنی این فناوری شده است. در حالی که تنها چند مطالعه به حساسیت دستگاه های پزشکی در برابر هک پرداخته اند ، خطر وجود دارد.
در سال ۲۰۰۸ ، دانشمندان کامپیوتر ثابت کردند که ضربان سازها و دفیبریلاتورها می توانند به صورت بی سیم از طریق سخت افزار رادیو ، آنتن و رایانه شخصی هک شوند.این محققان نشان دادند که می توانند یک دستگاه دفیبریلاتور و ضربان ساز ترکیبی قلب را خاموش کرده و مجددا برنامه ریزی کنند تا شوک های بالقوه کشنده ایجاد کنند یا باتری آن تمام شود. جی رادکلیف ، محقق امنیتی علاقه مند به امنیت دستگاه های پزشکی ، ترس از ایمنی این دستگاه ها را مطرح کرد.
او نگرانی های خود را در کنفرانس امنیتی کلاه سیاه بیان کرد. رادکلیف از آسیب پذیری دستگاه ها می ترسد و متوجه شده است که ممکن است حمله ای مرگبار علیه افرادی که دارای پمپ انسولین و مانیتور گلوکز هستند انجام شود. برخی از سازندگان تجهیزات پزشکی تهدید چنین حملاتی را کم اهمیت جلوه می دهند و استدلال می کنند که حملات نشان داده شده توسط محققان ماهر امنیتی انجام شده است و بعید است در دنیای واقعی رخ دهد. در عین حال ، دیگر سازندگان از متخصصان امنیت نرم افزار خواسته اند تا ایمنی دستگاه های خود را بررسی کنند.در ژوئن ۲۰۱۱ ، کارشناسان امنیتی نشان دادند که با استفاده از سخت افزارهای در دسترس و یک دفترچه راهنمای کاربر ، یک دانشمند می تواند اطلاعات سیستم پمپ انسولین بی سیم را در ترکیب با مانیتور گلوکز بررسی کند.
با پین دستگاه ، دانشمند می تواند دوز انسولین را به صورت بی سیم کنترل کند.آناند راغوناتان ، محقق در این مطالعه ، توضیح می دهد که وسایل پزشکی کوچکتر و سبک تر می شوند تا بتوان آنها را به راحتی پوشید. نکته منفی این است که ویژگی های امنیتی اضافی فشار بیشتری بر باتری و اندازه وارد می کند و قیمت ها را افزایش می دهد. دکتر ویلیام مایزل در مورد انگیزه مشارکت در این فعالیت افکاری ارائه کرد. انگیزه برای انجام این هک ممکن است شامل کسب اطلاعات خصوصی برای سود مالی یا مزیت رقابتی باشد. آسیب به شهرت سازنده دستگاه ؛ خرابکاری ؛
برای وارد آوردن صدمات مالی یا جانی یا صرفاً جلب رضایت مهاجم.محققان چند ضمانت را پیشنهاد می کنند. یکی از آنها استفاده از کدهای نورد است. راه حل دیگر استفاده از فناوری به نام “ارتباط بدن” است که از پوست انسان به عنوان راهنمای موج برای ارتباطات بی سیم استفاده می کند. در ۲۸ دسامبر ۲۰۱۶ ، سازمان غذا و داروی ایالات متحده توصیه های خود را منتشر کرد که از نظر قانونی برای حفظ امنیت دستگاه های متصل به اینترنت قابل اجرا نیست.
مشابه خطرات ، تهدیدها و آسیب پذیری های امنیت سایبری را نمی توان به طور کامل از بین برد ، اما باید مدیریت شود و به سطح معقولی کاهش یابد. [۷۸] هنگام طراحی وسایل پزشکی ، ریسک امنیت سایبری باید در مراحل اولیه تعیین شود تا بتوان آسیب پذیری و رویکرد مدیریت امنیت سایبری (شامل مجموعه ای از کنترل های طراحی امنیت سایبری) را تعیین کرد. رویکرد طراحی دستگاه های پزشکی باید با چارچوب امنیت سایبری NIST برای مدیریت خطرات مربوط به امنیت سایبری سازگار باشد.
در آگوست ۲۰۱۳ ، FDA بیش از ۲۰ مقرره با هدف بهبود امنیت داده ها در دستگاه های پزشکی [۷۹] در پاسخ به خطرات فزاینده امنیت سایبری محدود منتشر کرد.
هوش مصنوعی
تعداد دستگاه های پزشکی تأیید شده با استفاده از هوش مصنوعی یا یادگیری ماشینی (AI/ML) در حال افزایش است. تا سال ۲۰۲۰ ، چندین صدها دستگاه پزشکی AI/ML مورد تأیید FDA یا دستگاه های دارای نشان CE در اروپا وجود داشت. بیشتر دستگاه های AI/ML روی رادیولوژی تمرکز می کنند. از سال ۲۰۲۰ ، هیچ روش نظارتی خاصی برای دستگاه های پزشکی مبتنی بر AI/ML در ایالات متحده یا اروپا وجود نداشت. با این حال ، در ژانویه ۲۰۲۱ ، FDA یک چارچوب نظارتی پیشنهادی برای نرم افزارهای مبتنی بر AI/ML منتشر کردو مقررات دستگاه های پزشکی اتحادیه اروپا که جایگزین دستورالعمل دستگاه پزشکی اتحادیه اروپا در مه ۲۰۲۱ می شود ، الزامات نظارتی برای دستگاه های پزشکی را تعیین می کند. ، از جمله نرم افزار AI/ML.
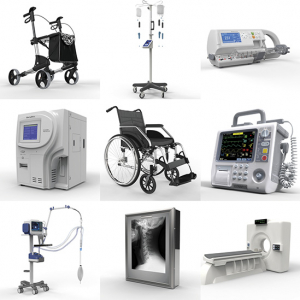
انواع
چندین نوع اساسی وجود دارد:
تجهیزات تشخیصی شامل دستگاه های تصویربرداری پزشکی است که برای کمک به تشخیص استفاده می شود. به عنوان مثال می توان به دستگاه های سونوگرافی و MRI ، اسکنرهای PET و CT و دستگاه های اشعه ایکس اشاره کرد.
تجهیزات درمانی شامل پمپ های تزریق ، لیزرهای پزشکی و دستگاه های جراحی لیزیک است.
از تجهیزات پشتیبانی زندگی برای حفظ عملکرد بدن بیمار استفاده می شود. این شامل ونتیلاتورهای پزشکی ، دستگاه های جوجه کشی ، دستگاه های بیهوشی ، دستگاه های قلب و ریه ، ECMO و دستگاه های دیالیز است.
مانیتورهای پزشکی به پرسنل پزشکی اجازه می دهند تا وضعیت پزشکی بیمار را اندازه گیری کنند. مانیتورها ممکن است علائم حیاتی بیمار و سایر پارامترها از جمله ECG ، EEG و فشار خون را اندازه گیری کنند.
تجهیزات آزمایشگاهی پزشکی خون ، ادرار ، ژن ها و گازهای حل شده در خون را به صورت خودکار یا تجزیه و تحلیل کمک می کند.
تجهیزات پزشکی تشخیصی نیز ممکن است در خانه برای اهداف خاصی استفاده شود ، به عنوان مثال. برای کنترل دیابت شیرین
درمانی: ماشینهای فیزیوتراپی مانند دستگاههای دامنه حرکت منفعل پیوسته (CPM)
شناسایی دستگاه های پزشکی اخیراً با معرفی Unique Device Identification (UDI) و نامگذاری استاندارد با استفاده از نامگذاری تجهیزات پزشکی جهانی (GMDN) که توسط انجمن بین المللی تنظیم کننده تجهیزات پزشکی (IMDRF) تأیید شده است ، بهبود یافته است. [۸۸]
تکنسین تجهیزات پزشکی (BMET) جزء حیاتی سیستم ارائه خدمات درمانی است. BMET ها که عمدتاً در بیمارستان ها مشغول به کار هستند ، مسئول نگهداری تجهیزات پزشکی یک مرکز هستند. BMET عمدتا به عنوان رابط بین پزشک و تجهیزات عمل می کند.
اهدای تجهیزات پزشکی
در دسترس بودن تجهیزات پزشکی از منظر بهداشت جهانی ، چالش هایی وجود دارد ، زیرا کشورهای کم منابع قادر به تهیه یا خرید تجهیزات ضروری و نجات دهنده زندگی نیستند. در این تنظیمات ، اهدای تجهیزات با نیت خوب از منابع با منابع کم به عنوان یک استراتژی مکرر برای حل این مشکل از طریق افراد ، سازمان ها ، تولیدکنندگان و موسسات خیریه است. با این حال ، مسائل مربوط به تعمیر و نگهداری ، در دسترس بودن تکنسین های تجهیزات پزشکی (BMET) ، زنجیره های تامین ، آموزش کاربران و مناسب بودن کمک ها به این معنی است که این موارد اغلب در ارائه مزایای مورد نظر شکست می خورند.
سازمان بهداشت جهانی تخمین می زند که ۹۵ درصد تجهیزات پزشکی در کشورهای با درآمد کم و متوسط (LMIC) وارداتی است و ۸۰ درصد آن توسط اهداکنندگان بین المللی یا دولت های خارجی تامین می شود.
در حالی که بیش از ۷۰ equipment تجهیزات پزشکی در کشورهای جنوب صحرای آفریقا اهدا می شود ، تنها ۱۰ تا ۳۰ of از تجهیزات اهدا شده عملیاتی می شود.مروری بر شیوه ها و دستورالعمل های فعلی برای اهدای تجهیزات پزشکی برای مراقبت های جراحی و بیهوشی در LMICs ، سطح بالایی از پیچیدگی را در فرایند اهدا و کاستی های متعدد نشان داده است.
همکاری و برنامه ریزی بیشتر بین اهداکنندگان و دریافت کنندگان همراه با ارزیابی برنامه های اهدا و حمایت هماهنگ برای آموزش اهداکنندگان و گیرندگان در مورد دستورالعمل ها و سیاست های اهدای تجهیزات ضروری است.

دیدگاه خود را ثبت کنید
تمایل دارید در گفتگوها شرکت کنید؟در گفتگو ها شرکت کنید.